0
Porównywać
0
Porównywać
 0
Kosz
0
Kosz

Porady i wskazówki
Instalacja kapilarnych kolumn GC
 Krótka procedura instalowania kapilarnych kolumn GC
Krótka procedura instalowania kapilarnych kolumn GC
- Ochłodzić wszystkie ogrzewane strefy GC
- Sprawdź środki do czyszczenia gazu i wymień w razie potrzeby
- oczyścić wtryskiwacz i detektor
- Wymień wkładkę wtryskiwacza / detektora na nową
- Wymień ważne uszczelki w inżektorze i detektorze
- Wymień przegrodę we wtryskiwaczu
- Ustaw przepływ gazów detektora
- Dokładnie sprawdź kolumnę, jeśli nie jest uszkodzona
- Przymocuj nakrętkę i skuwkę do każdego końca kolumny
- Cięcie 10 centymetrów z każdego końca kolumny. Do wycinania kolumn kwarcowych użyj szafirowego noża lub płyty ceramicznej. Do wycinania metalowych kolumn użyj płytki ceramicznej lub kwadratowego pilnika. Narzędzia do cięcia kolumn można znaleźć w naszym katalogu.
- Zawieś kolumnę kapilarną na uchwytach termostatu GC, aby uniknąć uszkodzenia
- Włóż żądany koniec kolumny do wtryskiwacza. Aby uzyskać prawidłową długość, należy zapoznać się z instrukcją obsługi GC.
- Zamontuj kolumnę tak, aby nie dotykała ścianek termostatu
- Ustaw natężenie przepływu według kolumny zgodnie z parametrami podanymi na chromatogramie testowym producenta
- Ustaw współczynnik podziału, płukanie przegrody i inne parametry zgodnie z wymaganiami producenta GC
- Upewnić się, że gaz nośny przepływa przez kolumnę. Zanurz wolny koniec kolumny w fiolce z rozpuszczalnikiem (aceton lub izopropanol).
- Włóż pożądany koniec kolumny do wykrywacza. Aby uzyskać prawidłową długość, należy zapoznać się z instrukcją obsługi GC.
- Sprawdzić szczelność kolumny za pomocą czujnika przewodnictwa cieplnego. Nie należy używać wody z mydłem ani wykrywaczy nieszczelności, ponieważ kolumna może ulec uszkodzeniu.
- Ustaw temperaturę wtryskiwacza i czujkę. Włącz wykrywacz po stabilizacji. Uwaga - Należy uważać, aby nie przekroczyć maksymalnej dozwolonej temperatury kolumny!
- Teraz ustaw prawidłową objętość martwą (prędkość liniową), rozpylając metan lub inny związeknie jest zatrzymywany przez kolumnę.
- Sprawdź kształt piku, który powinien być symetryczny
- Koncentrować kolumnę w maksymalnej temperaturze do momentu ustabilizowania linii bazowej detektora (maksymalna temperatura zastosowana w kolumnie z chromatogramem).
- Ustaw temperaturę termostatu i ponownie wstrzyknij metan lub inny, związek nie zatrzymany przez kolumnę. Dostosuj warunki dla optymalnej prędkości liniowej.
- Wstrzyknąć zduplikowaną mieszaninę testową kolumny i sprawdzić stan kolumny i całego układu chromatograficznego
- Skalibruj instrument, a teraz możesz pobierać próbki
Uwaga: Jeśli nowa kolumna, należy wykonać klimatyzację przed ustawieniem optymalnego czasu martwego.
Kondycjonowanie kolumn GC
 Kondycjonowanie kolumn chromatograficznych w podwyższonej temperaturze bez przepływającego gazu nośnego trwale uszkadza kolumnę. W przypadku wycieku tlen przenika do kolumny i, jeśli jest kondycjonowany w wyższych temperaturach, trwale ją uszkodzi. Dlatego przed kondycjonowaniem:
Kondycjonowanie kolumn chromatograficznych w podwyższonej temperaturze bez przepływającego gazu nośnego trwale uszkadza kolumnę. W przypadku wycieku tlen przenika do kolumny i, jeśli jest kondycjonowany w wyższych temperaturach, trwale ją uszkodzi. Dlatego przed kondycjonowaniem:
- sprawdź prawidłowe ustawienie natężenia przepływu przez kolumnę
- przeprowadzić kontrolę ciasta, aby uniknąć obecności tlenu w układzie chromatograficznym
Kondycjonowanie kolonii GC:
- zainstalować kolumnę w wtryskiwaczu. Nie podłączaj kolumny do wykrywacza (zostaw jej koniec w termostacie.
- ustawić początkową temperaturę termostatu GC na 40 ° C
- utrzymuj tę temperaturę przez 15 minut
- ustawić gradient temperatury na 10 ° C / min
- ustawić maksymalną temperaturę o 20 ° C powyżej maksymalnej wartości programu temperaturowego, w którym pracujesz (maksymalna temperatura musi być o 25 ° C niższa niż maksymalna dopuszczalna temperatura kolumny GC) *
- pozostawić kolumnę w wysokiej temperaturze przez noc i do momentu ustabilizowania linii bazowej wykrywacza. Jeśli kolumna jest wstępnie kondycjonowana, pozostaw ją w maksymalnej temperaturze przez 2 godziny i do momentu ustabilizowania linii bazowej wykrywacza.
* Uwaga: W przypadku wstępnie kondycjonowanych kolumn nie jest konieczne stosowanie warunkowania przez noc. Uważnie przeczytaj instrukcje dostarczone z Kolumną, które mają pierwszeństwo przed ogólnymi zaleceniami powyżej.
Połączenia HPLC (TN #539)
Niniejsza uwaga techniczna przedstawia możliwe rodzaje połączeń pomiędzy kolumną a systemem LC. Złe połączenie może mieć wpływ na separację szczytów i należy go unikać. Poniżej przedstawiono prawidłowe połączenie .

- TN_539_HPLC connections
1791 kB
Dopuszczalne dostosowania metod HPLC
Kolumny Chromservis HPLC odpowiadające metodom USP oraz zakres, w jakim można dostosować różne parametry testu chromatograficznego bez zasadniczej modyfikacji farmakopealnych procedur analitycznych, są wymienione w tej nocie technicznej . Zmiany inne niż wskazane wymagają ponownej walidacji postępowania.
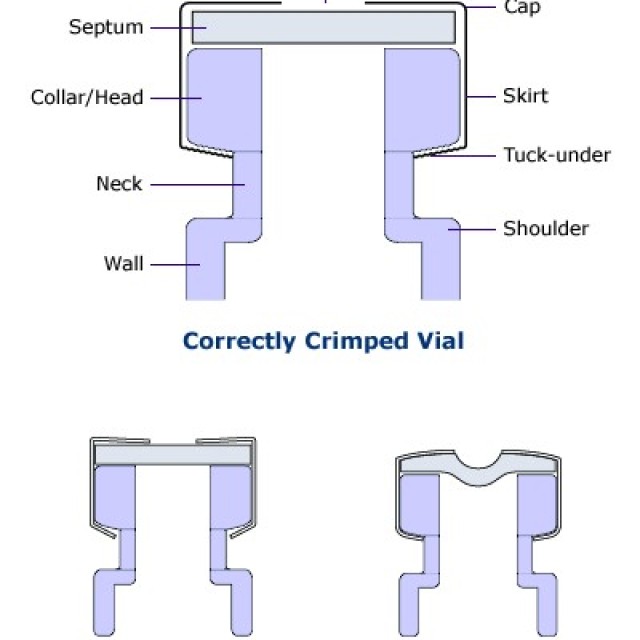
JAK PRAWIDŁOWO ZACISKAĆ FIOLKI
Fiolki zaciskane są doskonałymi pojemnikami na próbki do automatycznych dozowników chromatografów gazowych i cieczowych oraz do przechowywania próbek lub roztworów kalibracyjnych. Dla odpowiedniej szczelności bardzo ważna jest technika ich zamykania. W przypadku wycieku spowodowanego niewłaściwym uszczelnieniem może nastąpić odparowanie rozpuszczalnika lub utrata analitów.
Prawidłowo zamkniętą fiolkę można rozpoznać po tym, że jej wieczko po zamknięciu z trudem obraca się, a przegroda jest prosta.
Fiolkę zamykaną ze zbyt dużą siłą można rozpoznać po tym, że jej wieczko najczęściej nie daje się w ogóle odkręcić, a dodatkowo posiada wygiętą przegrodę (do wewnątrz). Jeżeli przegroda zostanie przekłuta igłą mikrostrzykawki, przegroda zostanie mocno obciążona, co spowoduje pogorszenie szczelności fiolki.
Fiolka, która nie posiada prawidłowo zamkniętej nakrętki ze względu na małą siłę szczypiec zaciskających, objawia się łatwym obracaniem nakrętki oraz, w niektórych przypadkach, rozwarciem materiału aluminiowego wokół dolnej krawędzi szyjki fiolki.
Można ustawić odpowiednią siłę szczypiec zamykających.
W starszych typach szczypiec siłę reguluje się obracając klucz imbusowy wewnątrz szczęk. Szczypce posiadają również śrubę oporową, która służy do ustawienia bezpiecznej odległości, aby nie używać zbyt dużej siły i tym samym uniknąć wycieku, a nawet mechanicznego uszkodzenia fiolki.
Wady i ich usuwanie
Większości problemów z urządzeniami GC i LC można uniknąć, przeprowadzając regularne konserwacje zapobiegawcze. Jeśli szukasz przyczyny problemu chromatograficznego, zawsze idź krok po kroku. Nigdy nie modyfikuj wielu parametrów naraz, ponieważ nie będziesz wiedział, które zmiany wpływają na wynik analizy chromatograficznej. .
Tutaj możesz wybrać obszar chromatograficzny, aby znaleźć wskazówki dotyczące rozwiązywania problemów:
Rozgałęzienie GC
Rozwiązywanie problemów LC
Zwiększenie stosunku sygnału do szumu w chromatografii gazowej
 Dzisiejsze potrzeby laboratoryjne to:
Dzisiejsze potrzeby laboratoryjne to:
- niższe limity wykrywania i kwantyfikacji (LOD, LQD)
- zwiększenie stabilności systemów GC i GC / MS
- wyższa bezwładność i stabilność składników GC (kolumny, przegrody, fiolki, wkładki, ...)
Można osiągnąć niższy poziom wykrywania i kwantyfikacji:
- zmniejszając hałas
- przez zwiększenie sygnału
Wybierz odpowiednią przegrodę dla GC
GC Agilent
| Wtryskiwacz | Chromatograf gazowy | Wymiary |
|---|---|---|
| Split-splitless | 7890, 6890, 6850, 5890, 5880A | 11 mm |
| Split-splitless | 5880, 5700 | 9,5 / 10 mm |
| PTV | 7890, 6890, 6850, 5890, 5880A | 11 mm |
| Na kolumnie | 7890, 6890, 6850, 5890 | 5 mm |
GC DANI
| Wtryskiwacz | Chromatograf gazowy | Wymiary |
|---|---|---|
| Split-splitless | Master, GC1000 | 12 mm |
| PTV | Master, GC1000 | 12 mm |
GC Perkin-Elmer
| Wtryskiwacz | Chromatograf gazowy | Wymiary |
|---|---|---|
| Split-splitless | Auto SYS, Auto SYS XL, 8000, 900, 990, Sigma | 11 mm |
GC Shimadzu
| Wtryskiwacz | Chromatograf gazowy | Wymiary |
|---|---|---|
| Split-splitless, PTV | 2010, 2014, 17A | "plug-septa" |
GC Varian
| Wtryskiwacz | Chromatograf gazowy | Wymiary |
|---|---|---|
| Spakowana kolumna | - | 9,5 / 10 mm |
| 1079, 1078 | - | 10/11 mm |
| 1177 | - | 9 mm |
| 1075/1077 | - | 11 mm |
GC Thermo Scientific
| Wtryskiwacz | Chromatograf gazowy | Wymiary |
|---|---|---|
| Split-splitless | Trace, 8000, 8000 TOP | 17 mm |
| PTV | 8000 | 17 mm |
| Split-splitless | Trace, GC9001 | 9,5 mm |
Mikroczipy
Czyszczenie i konserwacja mikrostrzykawki
Strzykawki chromatograficzne to bardzo precyzyjne i wysokiej jakości dozowniki mikropłytek. Są to jednak produkty, które należy dobrze zadbać. Zapewnia to ich długą żywotność i poprawia dozowanie próbek do chromatografów.
Niektóre rozpuszczalniki, takie jak chlorowcowane węglowodory, mogą uszkadzać wysoce klejący klej (części cementowane) mocujące igłę do korpusu mikrostrzykawki. Może to spowodować zapchanie tłoka lub zatykanie się igły.
Czyszczenie korpusu strzykawki
Strzykawki Hamilton i SGE najlepiej czyścić rozpuszczalnikami o znanej rozpuszczalności w celu najlepszego usunięcia pozostałości. Podczas czyszczenia preferuj rozpuszczalniki, które nie zawierają związków alkalicznych, fosforanów lub detergentów. Hamilton oferuje biodegradowalne rozwiązanie czyszczące (numer katalogowy 18311).
Przepłukać strzykawkę (wnętrze szklanego korpusu) dejonizowaną wodą, acetonem lub innym rozpuszczalnym w wodzie rozpuszczalnikiem (np. Metanolem). Następnie przepłucz strzykawkę heksanem i osusz. Unikaj długotrwałego zanurzenia strzykawki w roztworze czyszczącym.
Strzykawki MICROLITER ™ (seria 600, 700, 800, 900)
- Przepłukać strzykawkę rozpuszczalnikiem, który najlepiej rozpuszcza pozostałość próbki.
- Usuń tłok z korpusu strzykawki i delikatnie przetrzyj go szmatką, która nie zwalnia włókien (najlepiej zwilżona ściereczka w wybranym rozpuszczalniku). włożyć tłok z powrotem do korpusu strzykawki i kilkakrotnie wstrzyknąć / wydalić zdejonizowaną wodę. Powtórzyć procedurę za pomocą acetonu lub metanolu, a następnie za pomocą heksanu lub podobnego niepolarnego rozpuszczalnika.
- Osusz strzykawkę.
- Jeśli pracujesz z roztworami soli, zaleca się przechowywanie strzykawki z wyciągniętym tłokiem.
Strzykawki GASTIGHT® (seria 1000, 1700 i 1800)
- Przepłukać strzykawkę rozpuszczalnikiem, który najlepiej rozpuszcza pozostałość próbki.
- Usuń tłok z korpusu strzykawki i delikatnie przetrzyj go szmatką, która nie zwalnia włókien (najlepiej zwilżona ściereczka w wybranym rozpuszczalniku). włożyć tłok z powrotem do korpusu strzykawki i kilkakrotnie wstrzyknąć / wydalić zdejonizowaną wodę. Powtórzyć procedurę za pomocą acetonu lub metanolu, a następnie za pomocą heksanu lub podobnego niepolarnego rozpuszczalnika.
- Osusz strzykawkę.
- Jeśli pracujesz z roztworami soli, zaleca się przechowywanie strzykawki z wyciągniętym tłokiem
Przechowywanie strzykawek
Zalecamy przechowywanie strzykawek w ich oryginalnym opakowaniu. Doskonale chroni i dostarcza informacji na temat rodzaju strzykawki.
Desorpcja termiczna
 W tej sekcji przygotowaliśmy dla Ciebie ważne informacje podczas pracy z desorpcją termiczną. Jest to stosunkowo wymagająca metoda analityczna, aby ułatwić tę pracę. Jeśli nie znajdziesz informacji, których szukasz, skontaktuj się z naszymi specjalistami .
W tej sekcji przygotowaliśmy dla Ciebie ważne informacje podczas pracy z desorpcją termiczną. Jest to stosunkowo wymagająca metoda analityczna, aby ułatwić tę pracę. Jeśli nie znajdziesz informacji, których szukasz, skontaktuj się z naszymi specjalistami .
Pomiar emisji materiałów
- Показать все
Methyl cyclohexanone - detection tubes 2-100ppm, package 10 pcs
Доступность: по запросуНаведя справки
Methylcyclohexanol - detection tubes 2-100 ppm, package 10 pcs
Доступность: по запросуНаведя справки

YMC-Triart C18, высокого давления (450 bar) narrowbore HPLC колонка (2.1 mm i.d.), 12 nm, S-3 µm, 20 x 2.1 mm
Доступность: по запросуНаведя справки